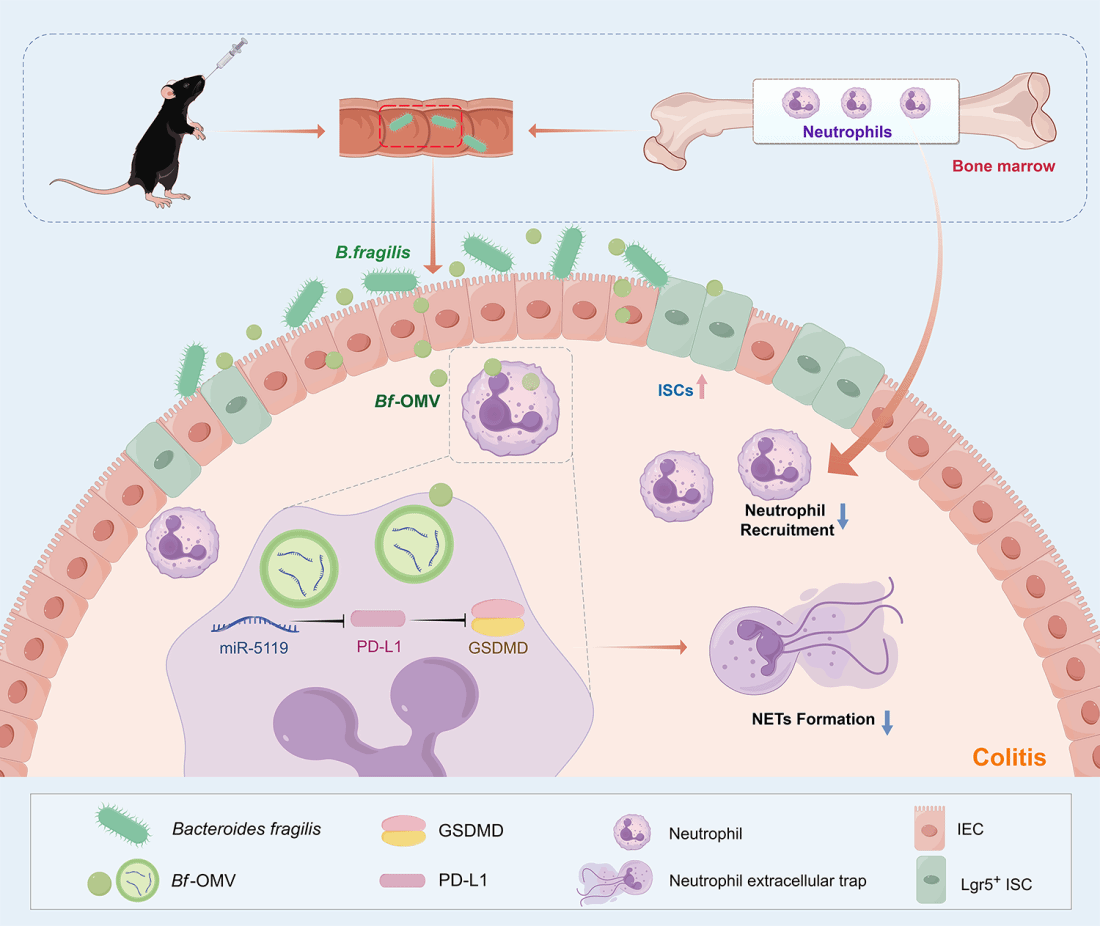
2025年6月25日,广州医科大学金域检验学院王立富教授团队在Advanced Science(Top期刊,中科院1区,IF=14.1) 在线发表了题为“Bacteroides Fragilis-Derived Outer Membrane Vesicles Deliver MiR-5119 and Alleviate Colitis by Targeting PD-L1 to Inhibit GSDMD-Mediated Neutrophil Extracellular Trap Formation”的研究论文。金域检验学院博士后杨宜为文章唯一第一作者。该研究首次揭示脆弱拟杆菌(Bacteroides fragilis)分泌的外膜囊泡(Bf-OMVs)通过递送miR-5119靶向抑制免疫检查点蛋白PD-L1,阻断GSDMD介导的中性粒细胞胞外诱捕网(NETs)释放,从而缓解结肠炎的分子机制。这一发现不仅阐明了共生菌源性细胞外囊泡在炎症性肠病(IBD)治疗中的免疫调节新功能,更为基于微生物囊泡的靶向疗法提供了新策略。

研究团队通过调控脆弱拟杆菌外膜囊泡分泌发现,促进囊泡分泌(BfOMVs+)显著增强结肠炎缓解效果,而抑制分泌(BfOMVs-)则削弱疗效。Bf-OMVs在DSS诱导的结肠炎模型中表现出肠道-脾脏-骨髓多器官靶向性,可被中性粒细胞高效内化并显著抑制NETs形成。机制研究表明,Bf-OMVs富含的细菌源sRNA 与真核miR-5119高度同源,通过直接靶向PD-L1 mRNA抑制其表达,进而下调GSDMD介导的NETs释放。在动物模型中,腹腔注射或口服Bf-OMVs均能减轻肠道炎症损伤,促进杯状细胞和肠道干细胞再生。值得注意的是,过度激活GSDMD可逆转Bf-OMVs的治疗效果,证实PD-L1/GSDMD/NETs信号轴的核心地位。该研究不仅为IBD的临床治疗提供了靶向性微生态疗法新策略,同时揭示了细菌sRNA调控真核基因的跨物种机制,为开发基于微生物囊泡的纳米药物奠定理论基础。
该研究得到广州医科大学高层次人才经费、广东省省企联合基金、广州市科技计划项目、广州市基础与应用基础研究项目、国家资助博士后人员计划、广州医科大学附属中医医院合作共建经费等项目资助。研究依托广州医科大学金域检验学院、广州医科大学医学检验大数据与经济研究所、广东省感染性疾病智能化诊断工程技术研究中心、广东省呼吸感染疾病预警和诊断工程技术研究中心、广州市传染性疾病临床快速诊断与预警重点实验室开展。动物实验依托于广州医科大学实验动物中心完成。广州医科大学金域检验学院为论文第一单位。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202500781


